authors: H. T. Abuluwefa
abstract:
The isothermal oxidation behaviour of some carbon steels under various experimental conditions was investigated. The composition of oxidation atmosphere used in this work was chosen to approximate atmospheres found in industrial steel billet reheat furnaces. In order to study the effect of adding each gaseous component in these atmospheres experiments were also conducted in atmospheres leading to these compositions. Since the most significant oxidation of the steel occurs at high temperatures, three temperatures of 1000°C, 1100°C and 1200°C were used in the experiments. In general, it was found that rates of oxidation in free oxygen atmospheres were higher than the rates of oxidation in nitrogen-based C02 and H20 atmospheres. For oxidation in atmospheres containing higher free oxygen content, the overall oxidation is unaffected by changing the concentration of H20 or C02. However, oxidation rates were found to be independent of oxygen concentrations above 6 vol.% 02. Metallographic examination of the oxides layers revealed that in the presence of free oxygen, the three iron oxides, wustite FeO, magnetite Fe304 and hematite Fe203 were all formed. However, for oxidation in nitrogen-based C02 and H20 atmospheres only the wustite phase was present.
이 저자는 철의 산화가 높은 온도에서 이루어지기 때문에, 1000℃, 1100℃, 1200℃에서 실험을 했고 다음과 같은 사실을 알아냈다.
1. 질소 베이스의 CO2, H2O 분위기에서 산화율보다 자유산화대기에서 산화율이 더 높다는 것을 발견
2. 산소 농도가 높으면 CO2, H2O의 농도 변화가 산화에 영향을 미치지 않는다.
3. 산화층은 원래 FeO, Fe3O4, Fe2O3가 형성되는데, 질소 베이스의 CO2, H2O 분위기에서는 FeO 상만 관찰된다.
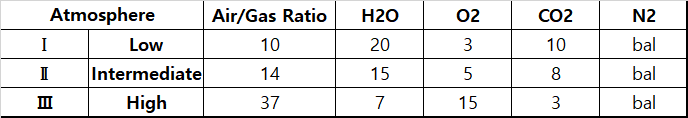
실험은 아래와 같이 3가지 Case로 진행되었다.
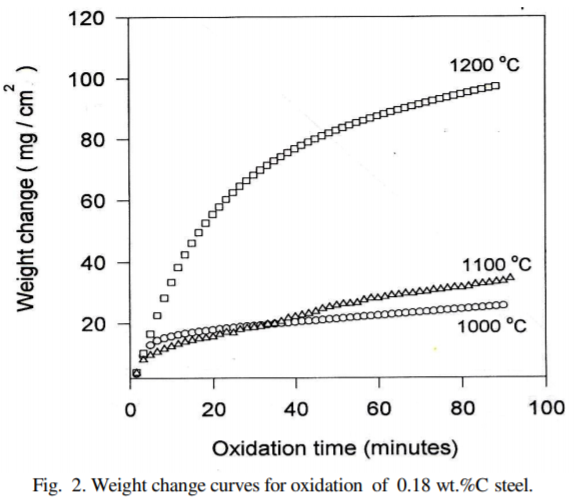
여기서 가장 나한테 가장 중요한 부분은 A. Effect of Temperature인데, 가장 낮은 온도인 1000℃에서는 산화 메커니즘이 Linear하다. 1200℃에서는 약 10분 후에 스케일층을 통한 산화 species(?)의 고체 확산에 의해 제어된다고 하는데, 확연히 눈에 보이는 것은 Linear하지 않으며 Log함수의 형태를 띄고 있다. 이는 Carbon 0.32%의 Steel에서도 유사한 양상을 보인다.
B. Oxidation Rate Constant
산화에 대한 parabolic rate constant는 0.18Carcon, 0.32Carbon의 각각 다른 온도대에서 매우 유사하게 나왔다. 최대 차이가 15%차이였다. Arrhenius Plot이 정확히 무엇을 뜻하는지는 모르지만, (위키피디아에서는 이렇게 설명되어있다. In chemical kinetics, an Arrhenius plot displays the logarithm of a reaction rate constant, (}

C. Comparision of Oxidation in the Three Atmospheres
산소 농도의 3%, 5%의 분위기에서 산화실험은 유사한 결과를 보여주었지만, 자유 산소가 15%일때는 달랐다. 차이는 초기 산화에서 나왔는데, 초기 산화율은 가스의 산소 농도에 매우 큰 영향을 미친다. 일반적으로 가열로 내에서 산화는 CO2, H2O의 농도 변화에 영향을 받지 않는다. 이에 대해서는 산소 농도를 변화시켜서 산화층이 얼마나 생기는지 실험을 해봐야할 것 같다. 현재는 1.2%이내로 낮게 관리되고 있다.
D. Metallographic Examination
0.72Carbon의 고탄소강에 대해서 실험실과 실제 가열로에서 산화 microstructure를 관찰한 결과는 유사하게 나왔는데 이때 산소 농도는 3 vol%였고, wustite, magnetite가 관찰되었다. 주로 wustite가 조직에서 많이 나왔다.
결론.
질소 베이스의 (O2, CO2, H2O) 분위기에서 고탄소의 등온 산화는 산소와 온도에 의존한다는 것이다. 1200℃에서 산소농도 6%까지는 산화물의 양이 증가하지만, 농도가 그 이상이면 더이상 증가하지 않는다. 대기 분위기에서 가장 중요한 것은 자유 산소이다. 이게 높을수록 초기 산화가 잘된다. Scale을 제어하기 위해서는 가열로에서 Free oxygen의 농도를 제어하는 것이 가장 핵심이다.
